近日,亚洲bet57365游戏大厅宋欣教授团队在植物领域国际著名期刊《新植物学家》(NEW PHYTOLOGIST; IF=10.151)发表了题为“Mesophyll conductance exerts a significant limitation on photosynthesis during light induction”的研究论文。

该研究聚焦变动光强诱导下的光合作用非稳态过程,通过将稳定同位素激光测量装置应用于光合生理性状叶肉导度(gm)的实时测量,首次揭示并量化光合诱导过程中gm对叶片碳同化吸收所起的关键作用,为深入理解田间复杂多变环境下植物光合效率的动态变化规律贡献了重要的基础性知识。宋欣教授是该论文的通讯作者,其团队成员刘涛博士后为论文第一作者,新西兰怀卡托大学Margaret M. Barbour教授以及博士后喻达时和饶森为论文共同作者。
光合作用是植物生理学研究的“经典”领域。深入理解光合作用对环境变化的响应规律可为解决人类社会面临的诸多挑战如农作物产量提升、气候变化应对、碳中和及碳达峰等提供科学支撑和实现路径。然而,传统的光合作用研究通常在光照强度维持不变的环境稳态下开展,这类“理想化”的测量环境与植物野生环境下光强由于受各种复杂因素的影响而不断动态波动的“现实”不符。有趣的是,光合速率对波动光强的响应并不是瞬时的,其往往需要经历几分钟到几十分钟不等的光诱导过程才能达到新的稳态。根据现有的作物模型预测,光诱导条件下光合作用缓慢“爬坡”的过程可导致光合效率损失及潜在农作物减产比例高达20%。因此,深入了解变动光强下光合动态过程的生理控制机制对于作物育种及生态系统生产力提升都具有现实意义。
CO2从叶内细胞间隙通过扩散作用到达叶肉细胞内部Rubisco酶羧化位点的导度(阻力的倒数)称为叶肉导度(gm)。已有的研究表明gm是限制稳态光合的主要因素之一;然而,受限于测试方法和技术,学界对于gm在光合诱导的非稳态过程中的所扮演的角色却知之甚少。为厘清该科学问题,宋欣团队采用激光吸收光谱技术(TDLAS)搭建了光合作用过程中碳同位素分馏的在线测量平台,可实现光诱导情景下gm的快速半连续测量。在本研究中,作者以模式植物拟南芥野生型和“开放气孔”突变体(ost1)作为测量对象,通过使用激光同位素在线测量手段量化探究光诱导过程中gm的时间动力学变化过程。研究结果揭示gm在高光诱导下会经历与气孔导度及RuBisco羧化酶活性类似的动态上升并最终达到稳态的过程,并发现gm诱导速率与RuBisco酶的活化速率相当甚至更慢,-- 该结果意味着学界所持的“gm几乎可以瞬时达到完全诱导”的主流观点可能并不正确。通过对光诱导过程进行积分并做光合限制性分析,作者进一步发现gm在光诱导全过程对光合效率施加的相对限制可高达35%;因此,gm毫无疑问是波动光强下非稳态光合作用的重要限制因子。鉴于上述实验结果,作者呼吁学界在未来研究中通过更多针对性的实验及生理过程建模深化对光诱导过程叶肉导度与其它生理因子动态耦合关系的认知,从而为全面深入理解非稳态环境下的光合生理调控机制补齐短板。
该研究得到国家自然科学基金委和深圳市科创委等支持。
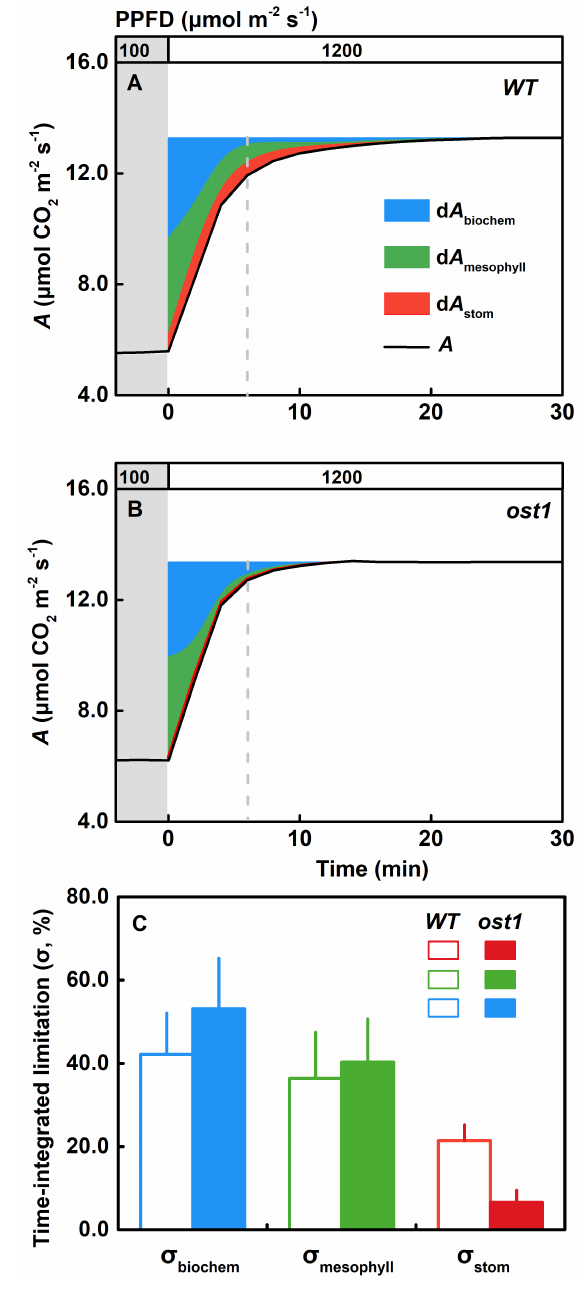
图1 光诱导过程中光合作用限制定量分析
原文链接:https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.17757


